
Diagrama de fases de uma sustância
A fase na qual uma substância se apresenta depende
de suas condições de pressão e temperatura. Desta forma, para cada substância
dizemos que há pares de valores dessas duas variáveis que correspondem à fase
sólida, pares que correspondem à fase líquida e par que corresponde à fase
gasosa.
Caso os possíveis pares de valores sejam lançados
em um diagrama cartesiano, no qual se coloca em ordenadas a pressão e em
abscissas a temperatura, obteremos, para um dado volume da amostra da
substância, o diagrama de fases da
substância. Em um diagrama de fases temos as seguintes transições:
1 – curva de fusão:
limita as regiões das fases sólida e líquida
2 – curva de vaporização: limita as regiões das fases líquida e gasosa
3 – curva de sublimação: limita as regiões das fases sólida e gasosa.
2 – curva de vaporização: limita as regiões das fases líquida e gasosa
3 – curva de sublimação: limita as regiões das fases sólida e gasosa.
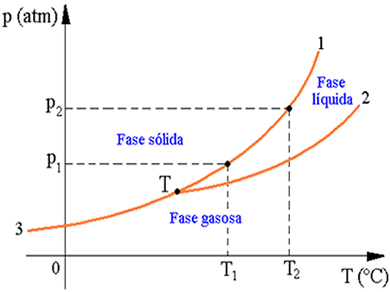
No estudo da termologia podemos dizer que a maioria
das substâncias obedece a um diagrama de fases. A figura acima é um caso de
representação de diagrama de fases, pois nele vemos que quanto mais alta for a
pressão exercida sobre uma substância, maior será a temperatura de mudança de
fase, sendo ela fusão, solidificação ou sublimação. Portanto, podemos ver no
gráfico acima que quando a pressão é p1, a
fusão ocorre à temperatura T1,
quando a pressão é p2, a
fusão ocorre a uma temperatura T2.
Algumas substâncias ditas anômalas fogem a essa
regra quando se fundem, é o caso de uma substância que temos contato
diariamente, a água, para essas substâncias tal regra não se aplica, pois
quanto maior for a pressão sobre elas, mais baixa passa a ser a temperatura de fusão.
Sendo assim, o diagrama de fases da água é representado da seguinte maneira:
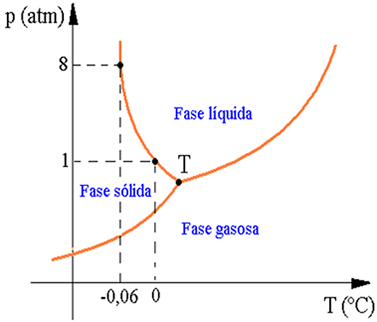
Podemos observar no diagrama acima que quando a
pressão é 1 atmosfera, a fusão do gelo se dá a uma temperatura de 0 ºC.
Entretanto, quando a pressão exercida é de 8 atmosferas, o gelo se funde a uma
temperatura mais baixa, cerca de -0,06 ºC.
A vaporização e a sublimação dessas substâncias
anômalas obedecem à regra geral. Portanto, para todas as substâncias, sem
exceção, a temperatura de vaporização, Tv, e a
temperatura de sublimação Ts, aumentam com
o aumento da pressão, p, exercida.
Nenhum comentário:
Postar um comentário